
Cuncursos, Vestibulares, Vestibulinhos e Carreira Militar
Links Patrocinados
Concursos
Vestibulares
Vestibulinhos
Carreira Militar
Material de Estudo
Links Patrocinados
Publicidade
Links Patrocinados
Calorimetria
Estuda as medidas das quantidades de calor.
-
Calor - energia térmica em trânsito
-
Calor Específico (c): É a quantidade de calor que cada grama de uma substância necessita trocar para variar sua temperatura em 1ºC. Quanto menor o calor específico de uma substância, mais facilmente ela pode sofrer variações em sua temperatura.
Obs.: O calor específico depende da substância e não da quantidade da mesma. Diferente da capacidade térmica.
Obs.2: No gráfico, substâncias diferentes de mesma massa possuirão inclinações diversas. A mais inclinada é a de maior calor específico; -
Equação Fundamental da Calorimetria - Quantidade de Calor Sensível (Qs);

Unidades:
- Unidade de Q:
1 caloria (1 cal) - quantidade de energia necessária para aquecer 1g de H2O em 1ºC;
1Kcal = 1000 cal;
- Unidade de m:
gramas (g);
- Unidade de c :
cal / g ºC
- Unidade de AQ:
ºC
-
Capacidade Térmica (C)
Razão entre a quantidade de calor trocada por um corpo e a correspondente variação de temperatura.
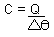
- Obs.: Outras equações possíveis:
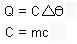
-
Unidade de C
- Cal / ºC
-
- Obs.2: A capacidade térmica depende da substância e também da quantidade da mesma.
-
Princípios das Trocas de Calor
Num recipiente termicamente isolados a soma das quantidades de calor é nula.
- Q(recebido) + Q(Cedido) = 0- Obs.: Numa troca de calor a temperatura de equilíbrio térmica fica mais próxima de quem possuí maior capacidade térmica. Se esta for a mesma, a temperatura de equilíbrio será a média aritmética da temperatura dos corpos envolvidos.
- Obs.2: Quando o calorímetro participa das trocas de calor, muitas vezes sua temperatura inicial é omitida. Quando isso acontecer deve-se considerar a temperatura inicial do calorímetro igual a da temperatura da 1º substância introduzida no mesmo.