
Cuncursos, Vestibulares, Vestibulinhos e Carreira Militar
Links Patrocinados
Concursos
Vestibulares
Vestibulinhos
Carreira Militar
Material de Estudo
Links Patrocinados
Publicidade
Links Patrocinados
Termodinâmica
Relaciona as trocas de energia entre um sistema (gasoso) e o meio
externo. Essas trocas podem acontecer envolvendo calor, energia interna
e trabalho.
-
Trabalho:
T = |F| |d| cos (teta) ;
T = P (AV) - Pressão Constante - (AV) equivale a "Delta V" ;
T = A - Numericamente igual a área formada no gráfico P x V ;
- Se Vi < Vf - AV>0 - T >0 - Trabalho realizado pelo gás ;
- Se V1>Vf - AV<0 - T <0 - Trabalho realizado sobre o gás ; -
1º Lei da Termodinâmica:
Um sistema gasoso troca energia com o meio através de calor e trabalho. A diferença entre eles corresponde à variação de energia interna (AU - Equivale a "Delta U").
AU = Q - T
Q = AU + T
- AU - Energia Interna Variada;
- Q - Quantidade de calor trocado;
- T - Trabalho Trocado;
AU em função da Temperatura:
AU = 3/2 n R AT - AT - Equivalente a "Delta T" ;
- Exemplo:
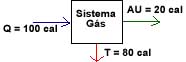
-
Transformação Adiabática:
Se Q = 0 Não existe troca de calor com o meio ;
Conclusão:
AU = -T
- Se T>0 : AU<0 ;
- Se T<0 : AU>0 ; -
Transformação Cíclica:
AU = 0
Q = T
T = A (Trabalho igual numericamente a área)
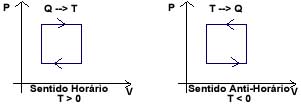
-
-
2º Lei da Termodinâmica:
É impossível obtermos rendimento de 100% quando 2 fontes térmicas são envolvidas (quente e frio);
T = Q1 - Q2-
Rendimento:
N = T / Q1
N = 1 - Q2 / Q1
-